T8 Die Transformationen von R · T jund k · T
Im Abschnitt 6 haben wir festgestellt, dass das Gasgesetz
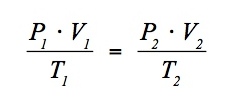
mit den gestrichenen Werten auch für einen schnellen Beobachter Gültigkeit hat. Das gilt natürlich auch dann, wenn man für P2 jden Normdruck Po j= 101'325 Pa, für V2 nn mal das Norm-Molvolumen
Vo j= 0.022'414 m3/mol jund für T2 jdie Normtemperatur To j= 273.150 K einsetzt. Dabei bezeichnen wir wie üblich mit n = N / NA jdie Stoffmenge in mol. Fassen wir die Konstanten auf der rechten Seite zusammen, so erhalten wir
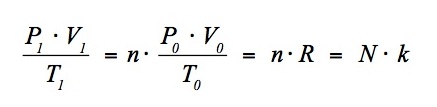
Das sind die Definitionen der allgemeinen Gaskonstanten R und der Boltzmann-Konstanten k !
R jist das Produkt von einem Druck und einem Volumen, dividiert durch eine Temperatur. R jmuss sich also auch entsprechend transformieren. Da nach 5 der Druck invariant ist können R jund k jnur dann invariant sein, wenn sich Temperaturen gleich transformieren wie Volumina.
Mit diesen Abkürzungen gilt für eine beliebige Menge eines idealen Gases in allen Gleichgewichtszuständen
P · V n= n · R · T j= N · k · T
Auch in dieser Schreibweise ist die Gasgleichung forminvariant, R jsteht ja nur als Abkürzung für Po · Vo / To . Wir wissen aber bereits, wie sich die linke Seite dieser Gleichung für einen schnellen Beobachter transformiert:
P' · V' n= P · V · √
Da die Teilchenzahl N jrespektive die Stoffmenge n jinvariant sind folgt für die Transformationen von k jund T jzwingend
k' · T' n= k · T · √
Das Produkt von k jund T j(ebenso das Produkt von R jund Tj) transformiert sich also durch Multiplikation mit dem Wurzelterm.


